Vous disposez de XX pour répondre à ce quiz.
Cliquez sur le compteur pour commencer
| Exercice 1 (/6pts): Le nitrate de calcium Ca(NO3)2 est un solide ionique. On l’utilise comme engrais. En effet, il aide la plante à développer des parois cellulaires robustes, ce qui améliore la qualité des fruits, ainsi que leur dure de conservation. On souhaite préparer une solution aqueuse de nitrate de calcium de volume V=500 mL et de concentration en quantité de matière d’ions nitrate de 2,00x10-2 mol/L. M(N)= 14,0 g/mol M(O)= 16,0 g/mol M(Ca)= 40,1 g/mol M(H)= 1,00 g/mol |
Question 1
Déterminer la valeur de la concentration en soluté à apporter c.
![]() C = 1,00x10-2 mol/L
C = 1,00x10-2 mol/L![]() C = 2,00x10-2 mol/L
C = 2,00x10-2 mol/L![]() C = 4,00x10-2 mol/L
C = 4,00x10-2 mol/L
Question 2
En déduire la masse de nitrate de calcium à dissoudre.
![]() 2.44x10-7 g
2.44x10-7 g![]() 3.05x10-5 g
3.05x10-5 g![]() 2.44x10-4 g
2.44x10-4 g![]() 6.57x10-3 g
6.57x10-3 g![]() 3.05x10-2 g
3.05x10-2 g![]() 8.21x10-1 g
8.21x10-1 g![]() 6.57 g
6.57 g![]() 820.5 g
820.5 g
Cliquez ici si vous souhaitez lire cet indiceFormule 1 : n= c*V, attention aux unités !
Cliquez ici si vous souhaitez lire cet indiceFormule 2 : m = M*n, vous devez avoir M=164.1 g/mol
| Exercice 2 (/2pts): |
Question 3
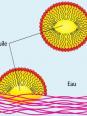
Voici une molécule de savon, identifier-lui chacune de ses parties
Cliquez ici si vous souhaitez lire cet indiceLipo = graisse / hydro = eau / phile = aime / phobe = n'aime pas
Question 4
Choisir le bon schéma :
| Exercice 3 (/2pts): |
Question 5
Nommer les interactions intermoléculaires de chaque solvant.
Question 6
Parmis les molécules de la question précédente, lesquels sont miscibles avec l'eau ?
![]() Juste l'acétone
Juste l'acétone![]() Juste le cyclohexane
Juste le cyclohexane![]() Juste l'éthanol
Juste l'éthanol![]() Acétone + cyclohexane
Acétone + cyclohexane![]() Cyclohexane + éthanol
Cyclohexane + éthanol![]() Acétone + éthanol
Acétone + éthanol![]() Tous les trois
Tous les trois
Question 7
Exercice 4 (/4pts): Quelles sont les trois étapes d'une dissolution dans l'ordre ?
| Exercice 5 (/6pts): Soit une solution aqueuse de sulfate de fer III (2Fe3+ + 3(SO_4)^2-) de concentration c obtenue par dissolution de Fe2(SO_4)3. |
Question 8
À quoi correspond cette concentration c ?
![]() Concentration de Fe3+
Concentration de Fe3+![]() Concentration de (SO_4)^2-
Concentration de (SO_4)^2-![]() Concentration de Fe2(SO4)3
Concentration de Fe2(SO4)3
Question 9
Exprimer [Fe3+] et [SO42-] en fonction de c.
![]() [Fe3+] = 2c
[Fe3+] = 2c![]() [Fe3+] = 3c
[Fe3+] = 3c![]() [(SO_4)^2-] = 2c
[(SO_4)^2-] = 2c![]() [(SO_4)^2-] = 3c
[(SO_4)^2-] = 3c![]() [Fe3+] = c/2
[Fe3+] = c/2![]() [Fe3+] = c/3
[Fe3+] = c/3![]() [(SO_4)^2-] = c/2
[(SO_4)^2-] = c/2![]() [(SO_4)^2-] = c/3
[(SO_4)^2-] = c/3
| Exercice 6 (/3pts): Pour les quatres questions suivantes, déterminer s’il s’agit de solide ionique ou moléculaire. Préciser ensuite si vous utilisez un solvant polaire ou apolaire pour le dissoudre. |
Question 10
Solide : saccharose C12H22O11
Question 11
Solide : Chlorure de lithium LiCl
Question 12
Solide : glace H2O
Question 13
Solide : Chlorure d'iode ICl
![]() Solide Ionique
Solide Ionique![]() Solide Moléculaire
Solide Moléculaire![]() Solvant polaire
Solvant polaire![]() Solvant apolaire
Solvant apolaire
Question 14
Exercice 7(/2pts): Donner la formule du solides ioniques formé de O^2- et Al^3+
![]() Al2O3
Al2O3![]() Al3O2
Al3O2![]() Al4O6
Al4O6![]() Al6O6
Al6O6
| Exercice 8 (/3pts): Compléter les nombres stœchiométriques (n) et charges éventuelles (q) des équations de dissolution dans l’eau des espèces des 3 questions suivantes. |
Question 15
FeBr3 -> Fe3+ + nBr^q
![]() N = 1 q = 3-
N = 1 q = 3-![]() N = 3 q = 1-
N = 3 q = 1-
Question 16
CoCl2 -> nCo^q + n'Cl-
![]() N=1 q=1+ n'=1
N=1 q=1+ n'=1![]() N=1 q=2+ n'=1
N=1 q=2+ n'=1![]() N=1 q=2+ n'=2
N=1 q=2+ n'=2![]() N=2 q=1+ n'=1
N=2 q=1+ n'=1![]() N=2 q=1+ n'=2
N=2 q=1+ n'=2![]() N=2 q=2+ n'=2
N=2 q=2+ n'=2
Question 17
Can(POn')n'' -> nCa2+ + n''(PO_4)^3-
![]() N=2 n'=3 n''=4
N=2 n'=3 n''=4![]() N=2 n'=4 n''=3
N=2 n'=4 n''=3![]() N=3 n'=4 n''=2
N=3 n'=4 n''=2![]() N=3 n'=2 n''=4
N=3 n'=2 n''=4![]() N=4 n'=2 n''=4
N=4 n'=2 n''=4![]() N=4 n'=4 n''=2
N=4 n'=4 n''=2
| Merci d'avoir joué ! Voilà c'est enfin terminé ! Je crois personnellement avoir mis trop de temps, donc dites-moi dans les commentaires combien de temps il vous restait quand vous l'avez terminé ainsi que si vous avez remarqué des erreurs ! N'oubliez pas de diviser votre score par 1.5 pour avoir une note sur 20 et avoir une idée de votre prochaine note en spé physique. On se reverra peut-être pour un autre quiz de physique chimie !! |












Commentaires